- Prima visita per difficoltà riproduttiva
- Accertamenti ed esami dopo la prima visita
- Seconda visita per difficoltà riproduttiva
- Inseminazione intrauterina
- FIVET/ICSI: secondo e terzo livello
- Iniezione sottocutanea
PMA: che cos’è la procreazione medicalmente assistita
La PMA (procreazione medicalmente assistita) è l’insieme delle procedure mediche che supportano o compensano uno o più aspetti della funzione procreativa, per consentire o aumentare le probabilità di concepimento e d’impianto di una gravidanza.
I livelli di PMA sono tre:
1° livello
Comprende le metodiche volte ad aumentare le probabilità di concepimento cercando di ottenere una fecondazione “in vivo” (all’interno del corpo femminile):
- induzione dell’ovulazione per rapporti mirati
- inseminazione intrauterina (IUI o Intrauterine Insemination): si stimola l’ovulazione con farmaci contenenti ormone follicolo-stimolante e si monitora lo sviluppo dei follicoli (tramite ecografia o talvolta con prelievi ormonali); in seguito si deposita lo sperma del partner (opportunamente trattato) nella cavità uterina, per favorire l’incontro con i gameti femminili (ovociti).
2°-3° livello
Con la fecondazione in vitro, l’incontro tra ovocita e spermatozoo avviene in laboratorio e dunque al di fuori del corpo umano. Dopo aver indotto un’ovulazione multipla attraverso la stimolazione delle ovaie, si procede al prelievo degli ovociti (pick-up ovocitario) e nella stessa giornata il partner maschile procede alla raccolta del liquido seminale. Una volta ottenuti i gameti femminili e maschili, ci sono due possibilità di fecondazione:
- FIVET (fecondazione in vitro embryo transfer – IVF – In vitro Fertilization): ovociti e spermatozoi vengono posti insieme in una piastra con terreno di coltura adatto e si lascia che gli spermatozoi penetrino l’ovocita in modo naturale.
- ICSI (iniezione intracitoplasmatica dello spermatozoo): microiniezione di un singolo spermatozoo direttamente all’interno della cellula uovo. È riservata ai casi in cui si valuta che, con la semplice inseminazione dell’ovocita, possano esserci problemi nell’ottenere la fecondazione. È considerata una metodica di PMA di III livello, quando è necessario l’utilizzo di spermatozoi prelevati chirurgicamente dal testicolo. Dopo la fecondazione, gli ovociti sono tenuti in coltura in laboratorio e trascorsi 2-6 giorni dalla fecondazione sono trasferiti nell’utero femminile (transfer embrionario).
Il congelamento degli ovociti
Gli ovociti maturi non utilizzati vengono congelati. Dopo scongelamento e ICSI gli embrioni vengono trasferiti in utero. Questa metodica è stata sviluppata e ha trovato i maggiori campi di applicazione nel nostro Paese. Inizialmente pensata per la preservazione della fertilità in pazienti oncologiche, ha trovato applicazione nelle coppie infertili che avessero ostacoli etici al congelamento embrionario e per il lungo periodo (2004-2009) di divieto del congelamento embrionario. Oggi viene utilizzata per aumentare le possibilità di dare un supporto alle scelte riproduttive della donna e limitare gli effetti negativi dell’età. È la nuova frontiera per la preservazione di una possibile fertilità futura nelle donne che devono o scelgono di procrastinare la ricerca di una gravidanza.
Il congelamento degli embrioni
Il congelamento degli embrioni non trasferiti dopo il prelievo degli ovociti è la chiave per ridurre il numero delle gravidanze multiple, consentendo alla donna una possibilità di successo in caso di esito negativo del trattamento o di ottenere una nuova gravidanza anche in caso di esito positivo del ciclo di induzione.
Diagnosi genetica preimpianto
Questa tecnica si avvale della possibilità di effettuare uno screening sull’assetto cromosomico (PGT-A) prima del trasferimento in utero effettuando una biopsia sulle cellule del trofectoderma.
Nel caso specifico di malattie genetiche trasmissibili alla progenie da uno o entrambi i partner, è possibile procedere con l’analisi monogenica (PGT-M).
Crioconservazione degli ovociti a scopo precauzionale
La crioconservazione degli ovociti a scopo precauzionale (anche chiamata “social freezing”) è una pratica clinica che permette di preservare la fertilità in donne che devono o vogliono posticipare il desiderio di maternità.
Al momento, numerosi studi scientifici hanno preso in considerazione migliaia di casi e hanno accertato l’assoluta sicurezza della procedura e dei risultati, anche a distanza di tempo.
Crioconservazione degli ovociti per pazienti con endometriosi
In linea con la delibera N. XI/7663 del 28/12/2022 di Regione Lombardia, Humanitas Fertility Center partecipa allo sviluppo e all’implementazione della rete regionale lombarda dei centri per l’informazione, l’educazione, la diagnosi precoce e l’inquadramento e il trattamento dell’endometriosi.
Le pazienti che rientrano nei criteri descritti di seguito possono accedere alla crioconservazione ovocitaria in convenzione con il sistema sanitario nazionale:
- Età ≤38 anni
- Presenza di endometriomi bilaterali
- Precedente enucleazione di endometrioma/i monolaterale/i e successiva recidiva omo o controlaterale
- Precedente enucleazione di endometriomi bilaterali senza o con recidiva omo, contro o bilaterale.
Che cos’è la prima visita per difficoltà riproduttiva e come funziona
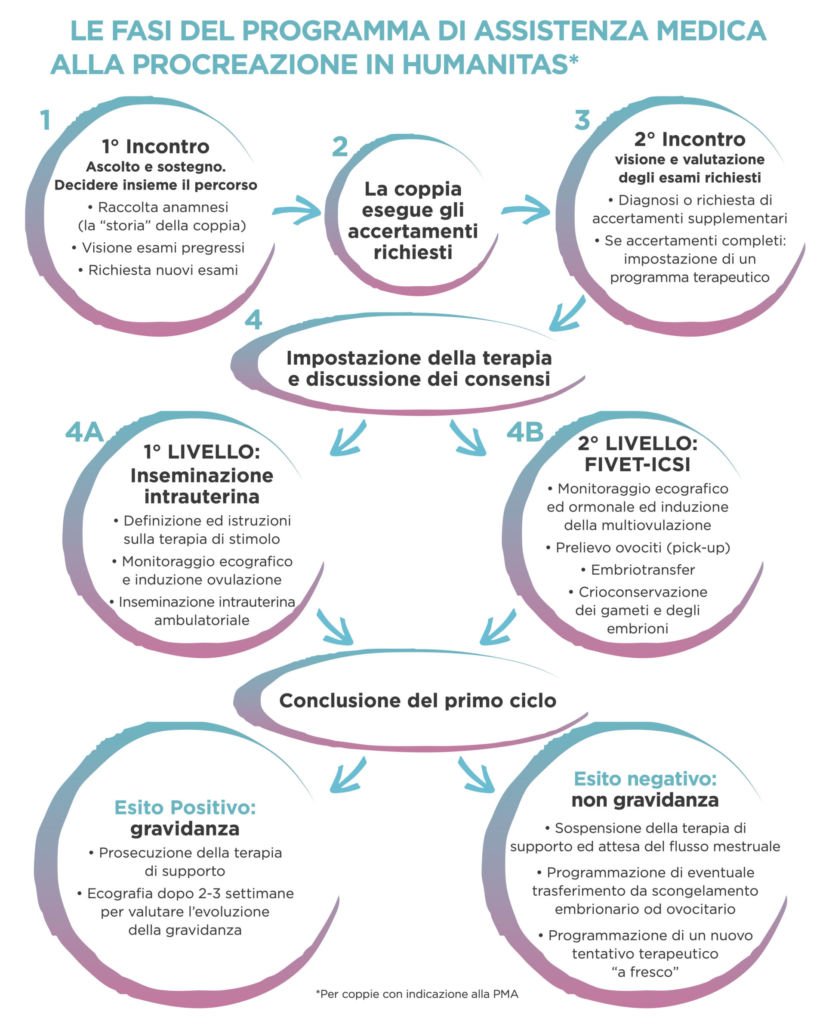
Il primo incontro è fondamentale per pianificare il percorso del programma, esaminare la documentazione, stabilire i tempi e definire la necessità e le modalità di accesso ai trattamenti.
È un momento importante per stabilire un legame tra la coppia e i medici di Humanitas Fertility Center che ne seguiranno passo dopo passo l’esperienza: per questo è utile, anche se non indispensabile, che siano presenti entrambi i partner.
Nel corso della prima visita viene effettuata una dettagliata anamnesi della coppia attraverso il controllo degli esami già effettuati e delle eventuali terapie o procedure eseguite in precedenza. Se necessario, verranno richiesti accertamenti supplementari.
Sulla base di questi dati e valutata la necessità di accedere a un percorso di PMA, si discutono con la coppia i passaggi necessari per accedere al programma, le implicazioni etiche e gli obblighi di legge. Fin dal primo incontro è possibile avvalersi di consulenze da parte di altri specialisti che affiancano l’équipe di Humanitas Fertility Center e, se necessario, di un supporto psicologico.
In questa fase viene anche illustrata l’indicazione che ha condotto alla necessità di una terapia di procreazione assistita. Per l’accesso alle tecniche di riproduzione assistita di II livello, uno degli specialisti dell’équipe, deve certificare, ai sensi dell’art.4 della legge 40 e delle linee guida del Ministero della Salute del 16/8/2004, lo stato di infertilità e l’accettazione all’interno del programma.
Accertamenti ed esami dopo la prima visita per difficoltò riproduttiva
Dopo la prima visita per difficoltà riproduttiva la coppia esegue gli accertamenti richiesti al fine di stabilire la metodica di PMA più opportuna e ottimizzare le probabilità di un esito positivo. Potrebbe, infatti, essere necessario cambiare tecnica, per esempio preferendo una ICSI alla fertilizzazione in vitro, laddove gli esami evidenziassero un peggioramento delle condizioni del liquido seminale rispetto ai controlli precedenti o altri accertamenti o procedure nelle coppie con numerosi precedenti fallimenti in altre strutture.
Per poter essere ammessa al programma di PMA La coppia deve eseguire alcuni accertamenti; alcune indagini sono richieste dalla normativa nazionale a tutela della coppia e del nascituro (Ministero della Sanità circolari n.19 del 27/4/87 e n.17 del 10/4/92) e dalle Linee Guida della legge 40/2004. Gli accertamenti consigliati sono stati rivisti nel corso della Consensus Conference dei Responsabili delle strutture Lombarde che erogano servizi di assistenza medica alla procreazione nel febbraio 2007. Gli accertamenti previsti tendono, in accordo con la normativa, ad assimilare la gravidanza da concepimento assistito alla gravidanza spontanea e a ridurre e semplificare gli esami richiesti in sede preconcezionale.
- Emogruppo e fattore Rh
- Emocromo
- Elettroforesi delle emoglobine (in caso di riduzione del volume cellulare medio e di alterazioni morfologiche degli eritrociti)
- Test di Coombs indiretto (in casi di emogruppo Rh negativo)
- Anticorpi anti rosolia IgG e IgM, anti toxoplasmosi IgG e IgM, anti Citomegalovirus IgG e IgM (se risultati negativi in precedenti accertamenti)
- HBsAg, HBcAb (IgG, IgM), HCV, TPHA, VDRL, HIV Test
- 2°/4° giorno del ciclo mestruale prelievo per dosaggio: FSH, LH, TSH, 17ß estradiolo, ormone antimulleriano, PRL
- 2°/5° giorno del ciclo mestruale ecografia transvaginale con morfovolumetria utero-ovarica, definizione dell’accessibilità delle ovaie al prelievo degli ovociti e conta dei follicoli antrali
- Tampone vaginale + cervicale con ricerca mirata Clamidia e Micoplasma
- Prelievo citologico cervico vaginale (Pap test)
- Mammografia e/o ecografia mammaria (in base all’età e alla condizione di rischio anamnestico)
- In casi selezionati: cariotipo su sangue periferico o altri accertamenti specifici emersi dalla storia clinica, screening della fibrosi cistica.
- Emogruppo e fattore Rh
- Elettroforesi delle emoglobine (in caso di riduzione del volume cellulare medio e di alterazioni morfologiche degli eritrociti)
- HBsAg, HBcAb (IgG, IgM), HCV, TPHA, VDRL, HIV Test
- Esame liquido seminale con test di capacitazione
In casi selezionati:
- MAR test (ricerca anticorpi antispermatozoo)
- test di frammentazione del DNA spermatozoario
- screening delle microdelezioni del cromosoma Y
- cariotipo su sangue periferico
- screening della fibrosi cistica
- Testosterone, FSH, LH, estradiolo
- altri accertamenti specifici emersi dalla storia clinica.
Se già disponibili non vanno ripetuti i seguenti esami genetici:
- gruppo sanguigno
- fibrosi cistica
- elettroforesi delle emoglobine
- cariotipo su sangue periferico
Oltre a questi esami comuni a tutte le coppie, potranno essere richieste altre indagini in base all’esito di questi accertamenti o in relazione all’anamnesi della coppia (cariotipo, microdelezioni del cromosoma y, screening fibrosi cistica della partner femminile, una consulenza genetica, accertamenti per un aumentato rischio di trombosi).
Una conoscenza esatta delle condizioni anatomiche del canale cervicale e della cavità permette di ottimizzare il trasferimento dei gameti fecondati e pertanto potranno essere indicati un trasferimento di prova, una sonoisterografia o un’isteroscopia.
Seconda visita
Durante il secondo incontro e/o in quelli successivi lo specialista controlla gli accertamenti richiesti alla coppia, si discute la necessità di accedere a una procedura di PMA, se l’indicazione non era emersa già nel primo incontro e si stimano le probabilità di raggiungere la gravidanza (prognosi). Con i medici dell’équipe è possibile affrontare le eventuali alternative terapeutiche alla fecondazione in vitro, l’impatto psicologico per la coppia e la famiglia e l’eventualità di ricorrere a un’adozione.
Talvolta vengono richiesti accertamenti aggiuntivi, per conoscere meglio le condizioni anatomiche del canale cervicale e della cavità uterina, al fine di ottimizzare il trasferimento dei gameti fecondati. Possono essere per esempio necessari in presenza di difetti congeniti o acquisiti della cavità uterina o per difficoltà riscontrate in transfer precedenti.
Le indagini richieste con maggior frequenza sono:
- ecografia 3D
- sonoisterografia
- isteroscopia diagnostica od operativa
- biopsia dell’endometrio
- transfer di prova
In presenza di difetti della pervietà tubarica o patologie degli annessi (tube e ovaie), potrebbe essere necessario eseguire un intervento di laparoscopia diagnostico od operativa, prima di intraprendere il successivo trattamento di PMA per decidere la possibilità di non ricorrervi o un trattamento meno invasivo o più vicino ai desideri personali della coppia.
Una volta terminati gli accertamenti richiesti, si stabiliscono le modalità e i tempi della procedura. Vengono spiegati i consensi previsti per le procedure in vivo o in vitro di secondo e terzo livello e l’eventuale necessità di un prelievo chirurgico degli spermatozoi (in caso di fattori maschili gravi); la firma dei consensi deve precedere di almeno 7 giorni l’inizio della terapia.
Infine, vengono specificati i costi della procedura sia per chi accede alla terapia privatamente sia per le pazienti assistite in convenzione con il Servizio Sanitario Nazionale (SSN), indicando i farmaci non prescrivibili a carico del SSN, i ticket e le eventuali prestazioni non incluse in convenzione.
Inseminazione intrauterina: primo livello
L’inseminazione intrauterina è una procedura di PMA di primo livello. Con questa tecnica di fecondazione in vivo si cercano di aumentare le possibilità di incontro tra i gameti (ovociti e spermatozoi) all’interno della tuba.
Si induce una blanda crescita follicolare multipla (massimo 2-3 follicoli) attraverso l’iniezione sottocutanea di basse dosi di gonadotropine (ormone follicolostimolante) o, in casi selezionati, mediante l’assunzione orale di citrato di clomifene. Dopo alcuni giorni di terapia, si inizia un monitoraggio ecografico dell’ovulazione per valutare il numero e le dimensioni dei follicoli (se indispensabile si esegue un dosaggio di estradiolo e progesterone plasmatico).
Dopo aver raggiunto un diametro follicolare corretto (intorno ai 18 mm), si procede prima all’induzione dell’ovulazione mediante l’iniezione sottocutanea di HCG e circa 36 ore dopo all’inseminazione, trasferendo in utero degli spematozoi precedentemente trattati in laboratorio al fine di renderli idonei alla fecondazione.
L’inseminazione avviene in ambulatorio, attraverso l’utilizzo di un catetere morbido introdotto attraverso la vagina e il collo dell’utero. Dopo qualche minuto, la donna può riprendere le normali attività. In genere, la sera dell’inseminazione si inizia una terapia di supporto della fase luteale mediante l’assunzione di progesterone per 14 giorni. Il progesterone sostiene l’endometrio (la mucosa di rivestimento della cavità uterina) rendendolo più adatto all’eventuale impianto di una gravidanza.
Trascorsi 14 giorni dall’inseminazione, viene richiesto alla donna di eseguire un esame del sangue per la rilevazione dell’HCG e valutare quindi un eventuale stato di gravidanza.In caso di negatività del test di gravidanza, la procedura può essere ripetuta più volte, purché tra un ciclo di stimolo e il successivo si esegua un’ecografia di controllo che confermi che non vi siano controindicazioni a procedere.
FIVET e ICSI: secondo e terzo livello
FIVET (fecondazione in vitro embryo transfer – IVF – In vitro Fertilization) e ICSI (iniezione intracitoplasmatica dello spermatozoo) sono le procedure di PMA di secondo e terzo livello. Si tratta di fecondazione in vitro, ovvero in laboratorio, al di fuori del corpo umano.
Attraverso la stimolazione ovarica si induce un’ovulazione multipla, per poi prelevare gli ovociti (pick up ovocitario); nella stessa giornata il partner maschile consegna al laboratorio un campione di liquido seminale.
Vengono così ottenuti i gameti maschili e femminili e si può procedere alla fecondazione in due modi:
- FIVET (secondo livello): si pongono ovociti e spermatozoi in una piastra con terreno di coltura adatto e si lascia che lo spermatozoo penetri l’ovocita in modo naturale
- ICSI (terzo livello): microiniezione di un singolo spermatozoo direttamente all’interno della cellula uovo
- PICSI: la selezione dello spermatozoo avviene utilizzando l’interazione con l’acido ialuronico.
In seguito alla fecondazione, gli ovociti vengono tenuti in coltura nel laboratorio di embriologia e trascorsi 2-5 giorni vengono trasferiti nell’utero della donna, mediante una procedura denominata transfer embrionario.
Induzione e monitoraggio dell’ovulazione
Un risultato positivo è strettamente legato alla risposta ovarica ottenuta (numero di follicoli, livello di estrogeni) e alla possibilità di prelevare almeno 3-4 ovociti maturi.
Per stimolare la produzione di più follicoli (e quindi di più ovociti) si prescrive una terapia tramite iniezioni sottocutanee (o talvolta intramuscolari) di gonadotropine ipofisiarie, al fine di indurre la maturazione contemporanea di più follicoli (ogni mese, infatti, solo uno dei 15/20 follicoli che l’ovaio prepara raggiunge la maturazione).
In alcuni casi è prescritta una terapia preliminare con un farmaco analogo del GnRH, mentre in altri casi alle gonadotropine può essere associato un farmaco antagonista del GnRH, per prevenire interferenze ormonali negative sulla risposta ovarica (picco spontaneo di LH – ormone luteinizzante).
Trascorsi circa 5-6 giorni dall’inizio della terapia di stimolazione si controllano periodicamente i livelli ormonali e il numero e il diametro dei follicoli, per monitorare la risposta ovarica e decidere il momento più adeguato al prelievo degli ovociti (pick-up ovocitario).
La risposta alla stimolazione e il controllo della terapia sono fondamentali per la buona riuscita del ciclo di terapia. L’uso della pillola (estroprogestinico) o di altri farmaci specifici è consigliato in molti casi nella preparazione della terapia d’induzione, perché consente di sincronizzare il ciclo al periodo previsto per l’inizio della cura, favorire una risposta omogenea dell’ovaio, e ridurre o annullare eventuali effetti collaterali dei farmaci a base di analoghi del GnRH.
L’induzione della multiovulazione si avvale, in base all’esperienza maturata nel mondo scientifico, di alcuni schemi di terapia che si possono riassumere in 2 grandi categorie:
- il primo protocollo prevede un’inibizione della risposta ipofisaria precedente l’inizio della terapia di induzione.
- il secondo protocollo non prevede questo passaggio e la terapia inizia dal 1°-2° giorno del flusso mestruale di un ciclo spontaneo o sincronizzato con l’assunzione di un estroprogestinico.
La risposta all’induzione per la crescita follicolare multipla può anche non esservi. È dunque possibile che la terapia non induca la crescita di un numero adeguato di follicoli o che il monitoraggio condotto sui livelli ormonali faccia ritenere di non poter prelevare ovociti maturi. In questi casi, limitati a meno del 15% dei cicli iniziati, occorre sospendere il trattamento.
La terapia di stimolo ha effetti collaterali?
Gli effetti collaterali della terapia di stimolo sono in genere modesti e di breve durata e possono variare da una lieve ritenzione idrica a un aumento di peso corporeo non diverso da quanto avviene nelle prime fasi di una gravidanza.
Il rischio più grave è la sindrome da iperstimolazione ovarica, un fenomeno descritto raramente anche in donne non sottoposte alle terapie di procreazione assistita, che determina un discreto aumento volumetrico delle ovaie, con produzione di liquido all’interno dell’addome e comparsa di sintomi talvolta importanti (dolore, senso di peso, difficoltà alla respirazione, diminuzione della diuresi). In rari casi, la sindrome può essere estremamente grave e per questo viene condotto ogni sforzo per limitarne l’incidenza.
Non sono stati descritti, invece, effetti a distanza di tempo dalla stimolazione ovarica, ossia collegati all’aumento di rischio per l’insorgenza di malattie, oppure che possano interferire con l’andamento di patologie preesistenti in modo differente da quelli a cui è esposta normalmente la donna in gravidanza.
Quali sono i farmaci utilizzati?
I farmaci vengono selezionati in base alle specifiche condizioni della coppia e alle esigenze del ciclo. È importante per l’équipe di Humanitas Fertility Center condividere con la coppia tutte le informazioni sul loro impiego, illustrando con precisione le linee guida che vengono seguite nella prescrizione farmacologica.
La disponibilità di trattamenti farmacologici per la fertilità è in continua evoluzione e Humanitas assicura un costante aggiornamento introducendo nuovi farmaci, in base alle revisioni della letteratura specializzata, e partecipando a protocolli clinici di ricerca, condivisi con la coppia.
I farmaci utilizzati per la soppressione del picco spontaneo di LH e la sincronizzazione del ciclo
Per aumentare le possibilità di gravidanza è fondamentale favorire la risposta ovarica e prevenire ed evitare le interferenze ormonali che possono ostacolare il buon esito della procedura.
L‘introduzione di analoghi del GnRH, l’ormone di rilascio delle gonadotropine, e più recentemente degli antagonisti del GnRH riveste grande importanza nella possibilità di ridurre l‘incidenza dei picchi spontanei di LH, l’ormone luteinizzante che deve essere controllato nelle terapie di induzione dell’ovulazione per consentire una maturazione regolare e sincronizzata di più ovociti contemporaneamente.
Gli analoghi del GnRH vengono in genere impiegati nelle procedure che prevedono la soppressione dell’ipofisi prima di iniziare la stimolazione.
Recentemente questa tipologia di farmaci può essere prescritta in associazione a un estroprogestinico (pillola),così da ridurre il periodo di somministrazione, il grado di soppressione ipofisaria e i sintomi a essa collegati, nonché l’iniziale effetto di stimolo, con lo scopo di poter impiegare dosaggi inferiori senza ridurne l’efficacia.
Nelle pazienti con una risposta pregressa non adeguata o ridotta, o in cui si sospetti questa condizione, gli analoghi del GnRH possono essere utilizzati in associazione alle gonadotropine per aumentare nei primi giorni la risposta ovarica, attraverso la sinergia tra le due molecole (effetto flare up).
Gli antagonisti del GnRH vengono proposti laddove si prevedano una risposta ridotta oppure una risposta eccessiva alla terapia di somministrazione. Vengono associati a un estroprogestinico per la sincronizzazione del ciclo e in genere abbreviano il periodo di induzione della multiovulazione.
Nelle paziente in cui si preveda una “normale” risposta ovarica, la scelta tra agonisti e antagonisti o se vi sia una sostanziale sovrapposizione dei protocolli in termini di probabilità di successo, è ancora oggetto di riflessione e di studio.
I farmaci utilizzati per l’induzione dell’ovulazione
Le gonadotropine (FSH ed LH) hanno rappresentato una rivoluzione nelle possibilità terapeutiche sia nell’induzione nelle pazienti anovulatorie, sia come terapia per la stimolazione della multiovulazione nelle procedure di procreazione assistita. Oggi, grazie all’introduzione di molecole derivanti dalla tecnologia del DNA ricombinante, disponiamo di prodotti più sicuri ed efficaci.
Tra i vantaggi delle nuove molecole ricombinanti, ci sono:
- una maggiore omogeneità dei farmaci
- una maggior efficacia clinica
- la possibilità di ricorrere a dosi inferiori di farmaco per gravidanza ottenuta.
I dosaggi impiegati vengono decisi sulla base della valutazione della riserva ovarica (conta dei follicoli antrali ed Ormone Antimulleriano), delle risposte a stimoli precedenti, dell’età della paziente e dell’indice di massa corporea (BMI). I dosaggi giornalieri variano da 75-100 UI in pazienti giovani con eccellente riserva ovarica, sottopeso e con tratto policistico a un massimo di 300 UI/die, limite che non viene in genere superato in quanto ritenuto inefficace, anche in pazienti con riserva ovarica compromessa.
Il monitoraggio ecografico e ormonale ha lo scopo di definire la risposta e ridurre per quanto possibile la quantità di gonadotropine somministrate e il rischio di iperstimolazione ovarica.
La recente introduzione di penne apposite o farmaci long active per l’autosomministrazione delle gonadotropine ha reso più agevole e ridotto gli effetti collaterali per la paziente.
Esiste nella nostra esperienza un rapporto diretto tra numero di ovociti recuperati e probabilità di successo (bimbi nati), anche senza considerare le gravidanze da crioconservazione, che giunge a ridurre l’effetto negativo dell’età.
Per questo motivo siamo al momento poco favorevoli a regimi di ‘mild o minimal stimulation’ proposti soprattutto dai Paesi del Nord Europa, in cui l’età media delle pazienti è notevolmente inferiore a quella delle nostre donne e in cui lo stesso tasso di gravidanza viene riportato solo attraverso un aumento del numero delle induzioni, prelievi degli ovociti e trasferimento degli embrioni.
Iniezione sottocutanea
Per indurre l’ovulazione ci si avvale di farmaci, spesso assunti tramite iniezione sottocutanea. La procedura può essere svolta agevolmente e in genere, chi si sottopone a un percorso di fecondazione assistita, impara a praticarsi da solo l’iniezione.
Le iniezioni sottocutanee possono essere fatte nella regione intorno all’ombelico, sui fianchi, nella porzione anteriore delle cosce, nella parte alta delle braccia (lato esterno o lato interno) e sotto la scapola. È consigliabile, qualora sia necessario sottoporsi a molte iniezioni, variare la zona in modo da limitare il rischio di reazioni locali al farmaco e di formazione di ascessi. Per effettuare un’iniezione sottocutanea è preferibile ricorrere a siringhe di piccole dimensioni, con aghi corti e sottili (25-28 gauge di diametro e 12-16 millimetri di lunghezza). La siringa dovrebbe essere un po’ più capiente rispetto al quantitativo da iniettare, in modo tale che lo stantuffo non sia quasi completamente fuori: questo renderà più agevole fare l’iniezione. Spesso occorre un ago per miscelare il farmaco e un altro per iniettarlo: è consigliabile dunque munirsi di siringhe con ago staccabile, in modo da poterlo sostituire.
Come prepararsi all’iniezione sottocutanea
- Lavarsi le mani e non toccare l’ago.
- Coprire l’ago con il cappuccio ogni qual volta lo si toglie o lo si mette sulla siringa.
- Verificare che il liquido sia limpido e iniettare il farmaco subito dopo aver aperto la fiala.
- Nel caso dei farmaci già pronti procedere aspirando con la siringa la quantità necessaria.
- Se il farmaco presenta due fiale (una con liquido e una con polvere) aspirare con la siringa il liquido e introdurlo nella fiala contenente la polvere. Aspettare pochi secondi che le due sostanze si miscelino e aspirare nuovamente tutto il liquido. Non è necessario agitare per favorirne il mescolamento.
- Rivolgere la siringa con l’ago verso l’alto e controllare l’eventuale presenza di bollicine, in caso positivo picchiettare con le dita sulla siringa per favorire la risalita delle bollicine. Premere poi lo stantuffo per consentire all’aria di fuoriuscire; in questa operazione è possibile che si perderà qualche gocciolina di farmaco, ma non c’è da preoccuparsi, i dosaggi prevedono questa piccola diminuzione.
Come fare l’iniezione sottocutanea
- Disinfettare la zona dove si è scelto di procedere con l’iniezione e aspettare che il disinfettante si asciughi.
- Impugnare la siringa e con il pollice e l’indice dell’altra mano afferrare una parte di pelle (come per fare un pizzicotto).
- Con una manovra leggera ma decisa inserire l’ago nel tessuto sotto la pelle mantenendo un’inclinazione di 45 gradi, iniettando così il farmaco senza raggiungere il muscolo.
- Rilasciare la pelle e iniettare il liquido lentamente. Durante questa procedura l’ago deve essere fermo.
- Sfilare l’ago con rapidità e tamponare il punto di iniezione con un batuffolo di cotone imbevuto di disinfettante.


